Harald Walanch, Universidad de Ciencias Médicas de Poznan, Hospital Pediátrico, 60-572 Poznan, Polonia. Rainer J. Clement, Departamento de Psicología, Universidad de Witten / Herdecke, 58448 Witten, Alemania. Wouter Akema, Change Health Science Institute, 10178 Berlín, Alemania.
1. Introducción
2. Métodos
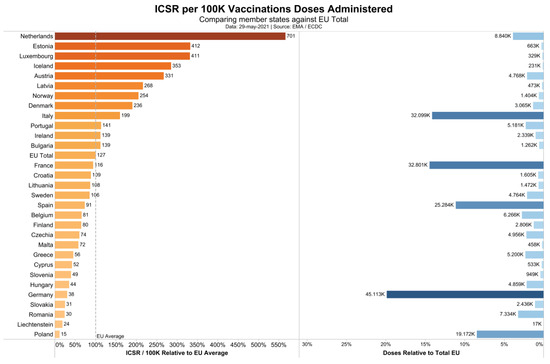
3. Resultados



4. Discusión
5. Conclusiones
La presente evaluación plantea la pregunta de si sería necesario repensar las políticas y usar las vacunas COVID-19 con más moderación y con cierta discreción solo en aquellos que están dispuestos a aceptar el riesgo porque se sienten más expuestos a la infección verdadera que a la infección simulada. . ¿Quizás sea necesario amortiguar el entusiasmo con hechos sobrios? En nuestra opinión, la EMA y las autoridades nacionales deberían promover una revisión de seguridad en la base de datos de seguridad de las vacunas COVID-19 y los gobiernos deberían considerar cuidadosamente sus políticas a la luz de estos datos. Idealmente, los científicos independientes deberían llevar a cabo revisiones exhaustivas de los casos muy graves, de modo que pueda haber recomendaciones basadas en la evidencia sobre quién es probable que se beneficie de una vacuna contra el SARS-CoV2 y quién está en peligro de sufrir efectos secundarios.
Referencias
- Arvay, CG Genetische Impfstoffe gegen COVID-19: Hoffnung oder Risiko. Schweiz. Ärztezeitung 2020 , 101 , 862–864. [ Google Académico ]
- Ramasamy, MN; Minassian, AM; Ewer, KJ; Flaxman, AL; Folegatti, PM; Owens, DR; Voysey, M .; Aley, PK; Angus, B .; Babbage, G .; et al. Seguridad e inmunogenicidad de la vacuna ChAdOx1 nCoV-19 administrada en un régimen de refuerzo primario en adultos jóvenes y ancianos (COV002): un ensayo simple ciego, aleatorizado, controlado, de fase 2/3. Lancet 2020 , 396 , 1979–1993. [ Google Académico ] [ CrossRef ]
- Walsh, EE; Frenck, RW; Falsey, AR; Kitchin, N .; Absalon, J .; Gurtman, A .; Lockhart, S .; Neuzil, K .; Mulligan, MJ; Bailey, R .; et al. Seguridad e inmunogenicidad de dos candidatas a la vacuna COVID-19 basada en ARN. N. Engl. J. Med. 2020 , 383 , 2439–2450. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Polack, FP; Thomas, SJ; Kitchin, N .; Absalon, J .; Gurtman, A .; Lockhart, S .; Pérez, JL; Marc, GP; Moreira, ED; Zerbini, C .; et al. Seguridad y eficacia de la vacuna COVID-19 de ARNm BNT162b2. N. Engl. J. Med. 2020 , 383 , 2603–2615. [ Google Académico ] [ CrossRef ]
- Baden, LR; El Sahly, HM; Essink, B .; Kotloff, K .; Frey, S .; Novak, R .; Diemert, D .; Spector, SA; Rouphael, N .; Creech, CB; et al. Eficacia y seguridad de la vacuna mRNA-1273 SARS-CoV-2. N. Engl. J. Med. 2020 , 384 , 403–416. [ Google Académico ] [ CrossRef ]
- Dagan, N .; Barda, N .; Kepten, E .; Miron, O .; Perchik, S .; Katz, MA; Hernán, MA; Lipsitch, M .; Reis, B .; Balicer, RD BNT162b2 ARNm COVID-19 Vacuna en un entorno de vacunación masiva a nivel nacional. N. Engl. J. Med. 2021 , 384 , 1412–1423. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Logunov, DY; Dolzhikova, IV; Shcheblyakov, DV; Tukhvatulin, AI; Zubkova, OV; Dzharullaeva, AS; Kovyrshina, AV; Lubenets, NL; Grousova, DM; Erokhova, AS; et al. Seguridad y eficacia de una vacuna COVID-19 heteróloga prime-boost basada en vectores rAd26 y rAd5: un análisis intermedio de un ensayo aleatorizado controlado de fase 3 en Rusia. Lancet 2021 , 397 , 671–681. [ Google Académico ] [ CrossRef ]
- Cunningham, AS Respuesta rápida: el candidato a vacuna COVID-19 no es impresionante: NNTV es de alrededor de 256. BMJ 2020 , 371 , m4347. [ Google Académico ]
- Folegatti, PM; Ewer, KJ; Aley, PK; Angus, B .; Becker, S .; Belij-Rammerstorfer, S .; Bellamy, D .; Bibi, S .; Bittaye, M .; Clutterbuck, EA; et al. Seguridad e inmunogenicidad de la vacuna ChAdOx1 nCoV-19 contra el SARS-CoV-2: informe preliminar de un ensayo controlado aleatorio, simple ciego, de fase 1/2. Lancet 2020 , 396 , 467–478. [ Google Académico ] [ CrossRef ]
- Klement, RJ; Bandyopadhyay, PS La epistemología de una prueba positiva de SARS-CoV-2. Acta Biotheor. 2020 . [ Google Académico ] [ CrossRef ]
- Ioannidis, JPA; Axfors, C .; Contopoulos-Ioannidis, DG Riesgo de mortalidad de COVID-19 a nivel de población para las personas no ancianas en general y para las personas no ancianas sin enfermedades subyacentes en los epicentros pandémicos. Reinar. Res. 2020 , 188 , 109890. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Rose, J. Un informe sobre el sistema de notificación de eventos adversos de vacunas de EE. UU. (VAERS) sobre los productos biológicos del ácido ribonucleico mensajero (ARNm) de COVID-19. Sci. Ley de Política de Salud Pública de 2021 , 2 , 59–80. [ Google Académico ]
- Edridge, AW; Kaczorowska, JM; Hoste, AC; Bakker, M .; Klein, M .; Jebbink, MF; Matser, A .; Kinsella, C .; Rueda, P .; Prins, M .; et al. La inmunidad protectora contra el coronavirus estacional es de corta duración. Nat. Medicina. 2020 , 26 , 1691–1693. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Havers, FP; Reed, C .; Lim, T .; Montgomery, JM; Klena, JD; Hall, AJ; Fry, AM; Cannon, DL; Chiang, CF; Gibbons, A .; et al. Seroprevalencia de anticuerpos contra el SARS-CoV-2 en 10 sitios en los Estados Unidos, del 23 de marzo al 12 de mayo de 2020. JAMA Intern. Medicina. 2020 , 180 , 1576–1586. [ Google Académico ] [ CrossRef ]
- Mateus, J .; Grifoni, A .; Tarke, A .; Sidney, J .; Ramírez, SI; Dan, JM; Burger, ZC; Rawlings, SA; Smith, DM; Phillips, E .; et al. Epítopos de células T de SARS-CoV-2 selectivos y de reacción cruzada en humanos no expuestos. Science 2020 , 370 , 89–94. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Doshi, P. COVID-19: ¿Mucha gente tiene inmunidad preexistente? BMJ 2020 , 370 , m3563. [ Google Académico ] [ CrossRef ]
- Lavine, JS; Bjornstad, ON; Antia, R. Las características inmunológicas gobiernan la transición del COVID-19 a la endemicidad. Science 2021 , 371 , 741–745. [ Google Académico ] [ CrossRef ]
- Brandal, LT; Ofitserova, TS; Meijerink, H .; Rykkvin, R .; Lund, HM; Hungnes, O .; Greve-Isdahl, M .; Bragstad, K .; Nygård, K .; Winje, BA Transmisión mínima de SARS-CoV-2 de casos pediátricos de COVID-19 en escuelas primarias, Noruega, agosto a noviembre de 2020. Eurosurveillance 2021 , 26 , 2002011. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ludvigsson, JF; Engerström, L .; Nordenhäll, C .; Larsson, E. Escuelas abiertas, COVID-19 y Morbilidad infantil y docente en Suecia. N. Engl. J. Med. 2021 , 384 , 669–671. [ Google Académico ] [ CrossRef ]
- Lorent, D .; Nowak, R .; Roxo, C .; Lenartowicz, E .; Makarewicz, A .; Zaremba, B .; Nowak, S .; Kuszel, L .; Stefaniak, J .; Kierzek, R .; et al. Prevalencia de anticuerpos anti-SARS-CoV-2 en Poznań, Polonia, después de la primera ola de la pandemia COVID-19. Vacunas 2021 , 9 , 541. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ioannidis, J. La tasa de mortalidad por infección de COVID-19 inferida de los datos de seroprevalencia. Toro. Órgano Mundial de la Salud. 2021 , 99 , 19F – 33F. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Bendavid, E .; Mulaney, B .; Sood, N .; Shah, S .; Ling, E .; Bromley-Dulfano, R .; Lai, C .; Weissberg, Z .; Saavedra-Walker, R .; Tedrow, J .; et al. Seroprevalencia de anticuerpos COVID-19 en el condado de Santa Clara, California. En t. J. Epidemiol. 2021 , 50 , 410–419. [ Google Académico ] [ CrossRef ]
- Lei, Y .; Zhang, J .; Schiavon Cara, R .; Él, M .; Chen, L .; Shen, H .; Zhang, Y .; Yin, Q .; Cho, Y .; Andrade, L .; et al. La proteína espiga del SARS-CoV-2 altera la función endotelial mediante la regulación a la baja de la ECA 2. Circ. Res. 2021 , 128 , 1323-1326. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Kowarz, E .; Krutzke, L .; Reis, J .; Bracharz, S .; Kochanek, S .; Marschalek, R. Síndrome de “mímica de COVID-19 inducido por vacuna”: las reacciones de empalme dentro del marco de lectura abierto de pico de SARS-CoV-2 dan como resultado variantes de proteína de pico que pueden causar eventos tromboembólicos en pacientes inmunizados con vacunas basadas en vectores (no pares preimpresión revisada). Res. Cuadrados 2021 . [ Google Académico ] [ CrossRef ]
- Farsalinos, K .; Eliopoulos, E .; Leonidas, DD; Papadopoulos, GE; Tzartos, S .; Poulas, K. Sistema colinérgico nicotínico y COVID-19: Identificación in silico de una interacción entre el SARS-CoV-2 y los receptores nicotínicos con posibles implicaciones terapéuticas. En t. J. Mol. Sci. 2020 , 21 , 5807. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Seneff, S .; Bueno, G. ¿Peor que la enfermedad? Revisando algunas posibles consecuencias no deseadas de las vacunas de ARNm contra COVID-19. En t. J. Práctica de la teoría de las vacunas. Res. 2021 , 2 , 38–79. [ Google Académico ]
- Alatawi, YM; Hansen, RA Estimación empírica de la notificación insuficiente en el Sistema de notificación de eventos adversos de la Administración de Alimentos y Medicamentos de EE. UU. (FAERS). Opinión de expertos. Drug Saf. 2017 , 16 , 761–767. [ Google Académico ] [ CrossRef ]
- Moore, TJ; Bennett, CL Informe insuficiente de las complicaciones hemorrágicas y trombóticas de los productos farmacéuticos a la Administración de Drogas y Alimentos de los EE. UU.: Hallazgos empíricos para warfarina, clopidogrel, ticlopidina y talidomida de la Red del Sur sobre reacciones adversas (SONAR). Semin. Trombo. Hemost. 2012 , 38 , 905–907. [ Google Académico ] [ CrossRef ]
- Hazell, L .; Shakri, SAW Subnotificación de reacciones adversas a medicamentos. Una revisión sistemática. Drug Saf. 2006 , 29 , 385–396. [ Google Académico ] [ CrossRef ]

